Pesquisadores desenvolvem ‘droga Cachinhos Dourados’ para tratar câncer de mama triplo negativo

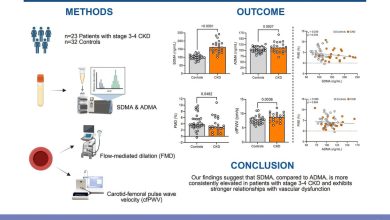
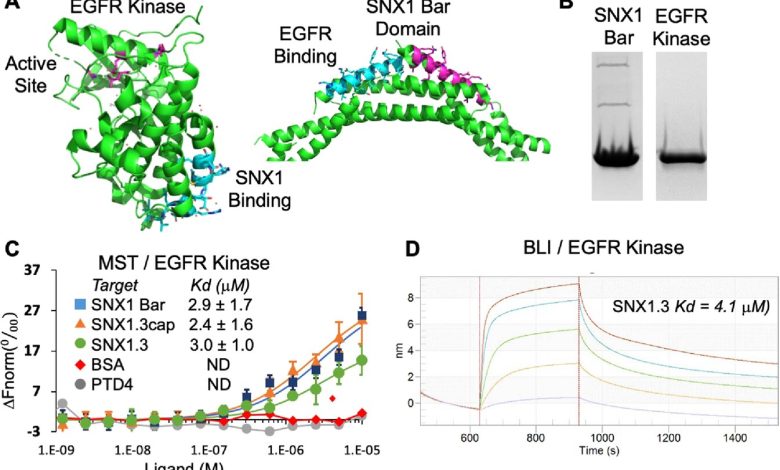
cSNX1.3 inibe competitivamente a ligação de EGFR a SNX1. UMA Desenho de fita do domínio quinase EGFR (PDB ID 5CNO) e domínio SNX1 Bar (PDB ID 4FZS). O sítio de ligação SNX1 proposto está bem longe do sítio ativo da quinase. B Géis de página SDS para domínio SNX1 Bar purificado (resíduos 301-522) e domínio EGFR quinase (resíduos 672-998). C Curvas de ligação de MST do domínio quinase EGFR (50 nM) com corante fluorescente ligado através da marca His titulada contra o domínio Bar, peptídeos SNX1.3 (capeados), SNX1.3 e PTD4 de controle, bem como BSA de controle. D A ligação de SNX1.3 ao domínio quinase também foi medida por Bio-Layer Interferometry (Octet BLI), que produziu uma constante de dissociação semelhante à medida por MST. Crédito: Terapia gênica do câncer (2022). DOI: 10.1038/s41417-022-00541-7
Após décadas de pesquisa e duas tentativas anteriores de desenvolvimento de medicamentos, as coisas parecem promissoras para uma equipe de pesquisadores da Universidade do Arizona trabalhando em um tratamento menos tóxico para um tipo específico de câncer de mama.
Os pesquisadores desenvolveram um composto de droga que parece parar crescimento de células cancerosas no que é conhecido como câncer de mama triplo negativo. A droga, que ainda não foi testada em humanos, demonstrou eliminar tumores em camundongos, com pouco ou nenhum efeito em células saudáveis normais, tornando-a potencialmente não tóxica para os pacientes.
A terapia é baseada em uma maneira recém-descoberta de um gene conhecido como receptor do fator de crescimento epidérmico, ou EGFR, leva ao câncer. O EGFR é um oncogene há muito investigado – um gene que, em certas circunstâncias, pode transformar uma célula em uma célula tumoral.
As descobertas dos pesquisadores são publicadas na revista Terapia gênica do câncere a equipe está trabalhando para obter a aprovação da Food and Drug Administration para testar o composto em ensaios clínicos de fase 1 em humanos.
O câncer de mama triplo negativo é responsável por cerca de 10 a 15% de todos os cânceres de mama. Triplo-negativo refere-se ao fato de que as células cancerígenas são negativas para os três outros tipos de câncer de mama – aqueles causados por muito estrogênio, muita progesterona ou muita proteína chamada HER2, de acordo com a American Cancer Society. O câncer de mama triplo negativo é mais comum em mulheres com menos de 40 anos que são negras ou que têm uma mutação específica em um gene chamado BRCA1. Cerca de metade de todos os casos de câncer de mama triplo-negativo superexpressam o oncogene EGFR, de acordo com os Institutos Nacionais de Saúde.
Os pesquisadores do UArizona criaram um composto que bloqueia o EGFR de ir para uma parte da célula que impulsiona a sobrevivência do câncer. O composto desliga o funcionamento da proteína EGFR que atua nas células cancerígenas, mas não nas células normais.
Muitas vezes, as drogas não são direcionadas o suficiente em seu ataque e, portanto, atacam partes de outras células saudáveis, resultando em efeitos colaterais indesejados. Os pesquisadores queriam evitar isso.
“O EGFR é conhecido por ser um oncogene há seis décadas, e há muitos medicamentos por aí tentando atingi-lo, mas todos eles tinham limitações que não os tornavam viáveis como medicamentos para o câncer de mama”, disse Joyce Schroeder, que co-escreveu o artigo com o autor principal Benjamin Atwell, um estudante de pós-doutorado no Departamento de Biologia Molecular e Celular.
Schroeder dirige o Departamento de Biologia Molecular e Celular da universidade e lidera o laboratório onde a pesquisa para o artigo foi conduzida. Ela também é membro do BIO5 Institute and Cancer Center da universidade.
As duas primeiras tecnologias de medicamentos que ela e sua equipe criaram funcionaram para matar as células cancerígenas, mas tiveram problemas.
Em sua primeira tentativa, os pesquisadores atingiram o que Schroeder chamou de parte “não estruturada” da proteína EGFR e, como resultado, o composto não conseguiu agir de forma consistente e confiável.
A segunda tentativa resultou em um composto que foi muito generalizado e atingiu uma parte da proteína que também impulsionava as atividades normais em células saudáveis, tornando a droga tóxica.
Para ser eficaz, Schroeder e sua equipe sabiam que tinham que desenvolver um composto que pudesse entrar em uma célula cancerosa e atingir a parte exata das proteínas criadas pelo gene EGFR para impedir a propagação do câncer. Eles conseguiram em sua terceira tentativa.
“Foi como o efeito Cachinhos Dourados”, disse Schroeder.
Ela e sua equipe sabiam que precisavam encontrar uma solução que não afetasse uma célula normal e que permanecesse ativa dentro do corpo.
“Quando testamos a droga em modelos animais, obtivemos este resultado fabuloso, onde na verdade não apenas impediu os tumores de irem, mas os fez regredir e desaparecer, e não estamos vendo efeitos colaterais tóxicos”, disse ela. . “Estamos muito animados com isso porque é muito específico do tumor”.
Como projetar uma chave para encaixar em uma fechadura muito específica, os biólogos moleculares e celulares idealmente projetam a química de drogas que irá interagir com o proteína alvo exatamente da maneira certa e nada mais.
“A segmentação do câncer de mama triplo-negativo tem sido difícil porque não tem uma dessas coisas óbvias para atingir”, disse Schroeder. “As pessoas sabem há muito tempo que as células de câncer de mama triplo-negativas expressam EGFR, mas quando as drogas conhecidas de EGFR foram lançadas, elas não responderam”.
Muitos pesquisadores pensaram que talvez o EGFR não devesse ser o alvo, então eles procuraram por novos. Schroeder, por outro lado, acha que o EGFR está apenas funcionando de uma maneira que os pesquisadores ainda não entendem. Ela e sua equipe tentaram direcioná-lo de uma maneira inovadora, com sucesso.
O próximo passo, além dos testes em humanos, é testar a capacidade da droga de suprimir a metástase, que ocorre quando células cancerosas se espalhou para outras partes do corpo, disse Schroeder.
Os pesquisadores têm trabalhado para proteger o propriedade intelectual e investir ainda mais no licenciamento do ativo com a Tech Launch Arizona, o escritório universitário que comercializa inovações universitárias.
Benjamin Atwell et al, Classificando o direcionamento terapêutico dependente de nexina do receptor do fator de crescimento epidérmico oncogênico, Terapia gênica do câncer (2022). DOI: 10.1038/s41417-022-00541-7
Fornecido por
Universidade do Arizona
Citação: Pesquisadores desenvolvem ‘droga Goldilocks’ para tratar câncer de mama triplo-negativo (2022, 25 de outubro) recuperado em 25 de outubro de 2022 em https://medicalxpress.com/news/2022-10-goldilocks-drug-triple-negative-breast-cancer .html
Este documento está sujeito a direitos autorais. Além de qualquer negociação justa para fins de estudo ou pesquisa particular, nenhuma parte pode ser reproduzida sem a permissão por escrito. O conteúdo é fornecido apenas para fins informativos.